
「생명윤리 및 안전에 관한 법률」 2조에서 ‘유전자치료란 질병의 예방 또는 치료를 목적으로 인체 내에서 유전적 변이를 일으키거나, 유전물질 또는 유전물질이 도입된 세포를 인체로 전달하는 일련의 행위를 말한다’라고 정의하고 있다. 이를 기반으로 유전자치료는 기술적으로 세 분야로 구분된다. 바로 1) 기능적 유전자를 전달하여 결여된 유전자 기능을 수복하는 유전자 전달 치료제(gene delivery therapy) 2) 인체 내에서 유전적 변이를 일으키는 기술인 유전자 편집 치료제(gene editing therapy) 3) 다양한 방식으로 유전자의 변형을 꾀한 세포를 인체에 주입하는 방식의 유전자세포 치료제(gene-modified cell therapy)의 세 분야다.
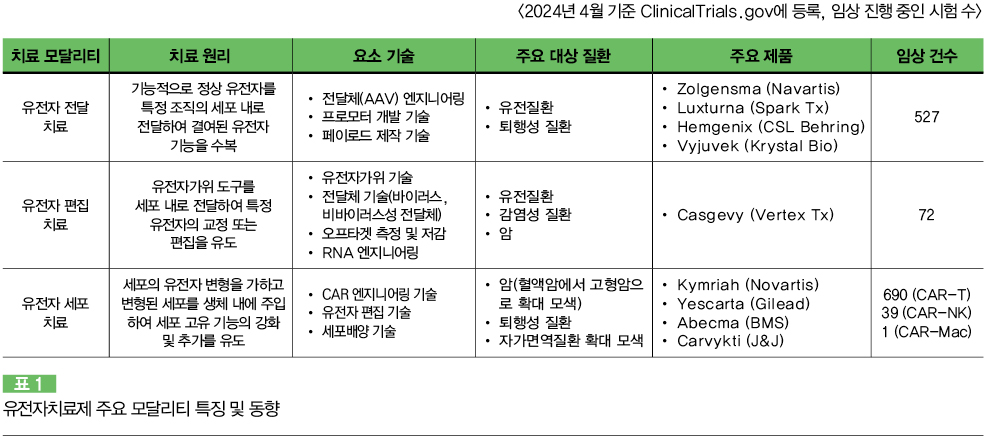
유전자 전달 치료제는 아데노연관바이러스(AAV, Adeno-associated Virus)라는 비교적 안전하고 효과적인 전달체에 힘입어 유전질환의 치료제로 상업화가 이루어졌다. 가족성 지질단백분해효소 결핍증을 치료할 수 있는 uniQure社의 글리베라(Glybera)를 모태로 유전성 망막질환 치료제인 럭스터나(Luxturna), 척수성 근위축증(Spinal Muscular Atrophy, SMA) 치료제인 졸겐스마(Zolgensma)로 상업화가 이어졌다. 이렇게 유전자 전달 치료제는 유전자치료의 주요 치료법이 되었다.
유전자 편집 치료제에서는 크리스퍼라는 혁명적인 유전자가위 기술에 힘입은 카스게비(Casgevy)의 승인 성공이 있었다. 이를 발판 삼아 유전자 편집 치료제는 향후 in vivo(생체 내) 영역으로 확대될 것으로 기대된다.
유전자 세포 치료제가 두각을 나타내고 있는 분야는 단연 CAR-T 치료제(Chimeric Antigen Receptor T cell Therapy)로 대변되는 항암면역세포 치료 분야다. 다수의 CAR-T 제품이 혈액암 치료제로 승인받았다. 이에 CAR-NK(Natural Killer)가 가세하면서 암치료시장의 판도를 바꾸고 있다. 유전자 세포 치료제는 고형암 및 자가면역질환으로의 확대까지 모색하고 있다.
유전자치료제는 기존의 바이오의약품이 보였던 단점들을 극복하고 다음과 같은 장점들을 살려, 희귀 난치질환 치료의 주요 모달리티로 자리매김하고 있다. 첫째, 일 또는 주 간격의 반복적인 투여로 인해 발생하는 환자의 불편 및 부작용의 문제를 해결했다. 유전자치료제는 단회 투여로 거의 영구적인 치료 효과를 거둘 수 있다. 둘째, AAV와 같은 효율적인 전달체를 통해 다양한 조직으로 치료 영역을 확대했다. 셋째, 근본적으로 개인맞춤형 치료에 기반을 두고 있어 전달체가 갖는 독성 외에는 그 자체로 커다란 독성이 유발되지는 않는다. 마지막으로, 유전자치료제가 표적 하는 질환 자체가 대부분 희귀질환이므로 신속심사나 희귀의약품 지정 등을 통해 개발·허가 기간을 단축할 수 있다는 측면이 개발자들에게 긍정적인 요소로 작용한다. 다만, 보다 효율적인 전달체 기술, 오프타겟 절감 기술, 자가 치료에서 동종 치료로의 확대, 장기적 안전성의 검증 등의 리스크가 해결된다면 유전자치료제가 산업에서 차지하는 비중은 매우 확대될 것이다.
바이오의약품은 재조합 단백질과 항체를 거쳐 첨단바이오의약품으로 패러다임이 변하고 있다. 전체 의약품의 연간 성장률은 3~6%에 그치지만, 유전자치료제 시장의 연평균 성장률은 2030년까지 40%에 육박할 것으로 예상된다. 즉, 향후 치료제 산업을 유전자치료제가 견인하게 될 것이라 해도 과언이 아니다.
이 중심에는 유전자 전달 치료제, 유전자 편집 치료제, 유전자 세포 치료제가 있다. 유전자치료제는 기존의 약물들과 달리 다양한 기술들의 접목이 필요하다. 따라서 유전자치료 산업을 선점하기 위해서는 국가적 차원에서 다학제적 연구를 수행하고, 이를 위한 오픈 이노베이션 시스템과 산업 생태계를 구축하도록 노력해야 한다.
아직까지 인류는 유전자치료제가 보여준 탁월한 효과성에 비해 안전성에 대해 충분한 경험이 없다. 유전자치료제에 대한 충분한 경험치가 축적된다면 현재 희귀 난치질환에 적용되고 있는 적응증의 한계를 넘어 대사질환 및 다양한 퇴행성 질환, 노화의 영역까지 치료의 범위가 확대될 것으로 기대된다.





