신약 개발에 있어 미국 식품의약국 FDA의 승인을 받는 것은 글로벌 시장 진출의 핵심 관문과도 같다. 130년 가까운 제약산업 역사에서 국내 개발 신약이 미국 FDA의 관문을 넘은 것은 아주 최근의 일이며 그 숫자도 10여 건에 불과하다.
GC녹십자가 개발에 성공한 알리글로는 FDA 승인을 통과한 것은 물론이고, 세계 최대의 미국 시장에서 고마진 정책, 높은 환자 접근성, 계약 최적화 등의 핵심 전략을 바탕으로 성공적인 시장 데뷔를 이루어 냈다.
알리글로는 DS(Drug Substance)뿐만 아니라 완제의약품을 말하는 DP(Drug Product)허가를 받은 것이다. DS허가는 신약의 활성 성분 자체에 대한 허가이고, DP(Drug Product)허가는 인체에 투약되는 최종 제형을 허가받는 것이기 때문에 알리글로와 같은 주사제의 경우 무균성을 확보해야 하고 포장, 보관, 유통 조건에서 품질 유지 여부까지 모두 허가의 대상이 되므로 더 까다롭고 어려운 DP 허가를 받은 몇 안되는 국내 개발 및 생산 완제 신약이다.
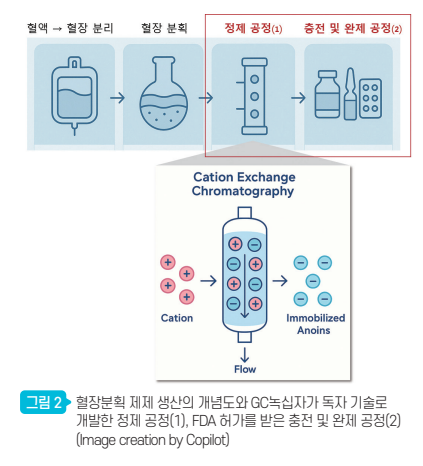
GC녹십자의 알리글로는 면역글로불린 제제에서 가장 큰 잠재적 리스크인 혈액응고인자의 잔존 가능성을 양이온 교환 색층 분석법이라는 정제 기술을 공정에 도입하여 ‘제로’에 수렴시켰다. 혈액응고인자는 미량으로도 혈액응고를 유도하여 혈전을 만들고 혈관을 막히게 할 수 있는 위험인자이다.
2008년에 면역글로불린 10% 제제 개발을 기획하고, 미국 시장 진출을 목표로 하여 2009년 개발에 착수한 이후 최종 허가와 미국 시장 진출까지 15년이란 긴 시간 동안 GC녹십자가 고민한 것은 “노하우의 축적이 일어나기 위해 어떻게 하면 기술을 체계적으로 저장할 수 있을까?’였다.
신기술을 기획하는 단계부터 개발과 생산까지 이어지는 모든 과정을 총 10단계로 구분하여 단계별로 반드시 만들어야 할 문서 목록과 문서에 포함되어야 할 필수 내용들을 정해서 다음 단계로 넘어가기 전에 엄격하게 심사하고, 문서가 미비할 경우 다음 단계로 넘어가는 것을 허용하지 않음으로써 기술을 저장하는 방법을 체계화하였다.
지식이 누적되어 축적이 일어나면 그 지식에 연구원들이 쉽게 접근할 수 있도록 하여 지식의 ‘Debating’이 활발히 일어나도록 하였으며, 이를 위해 연구원들 사이에서 직책에 영향을 받지 않는 수평적 사고를 할 수 있는 조직 문화를 만들어 온 결과가 오늘의 기술혁신에 핵심적인 성공 요인이라 할 수 있다.
글로벌 기업이 이미 면역글로불린 제제 주요 시장 대부분을 점유한 상황에서 알리글로는 가장 큰 무대인 미국 시장 자력으로 진출하는 데 성공하였고, 출시 1년 만에 두 자릿수 성장률을 기록하며 프리미엄 제품으로 인정받았다. 현재 GC녹십자는 안전성이 세계 최고 수준이면서 동시에 환자의 편리성도 최고를 추구하는 피하투여 방식의 면역글로불린 신제품 개발에도 집중하고 있다.